 pH wody
pH wodySens fizyczny skali pH
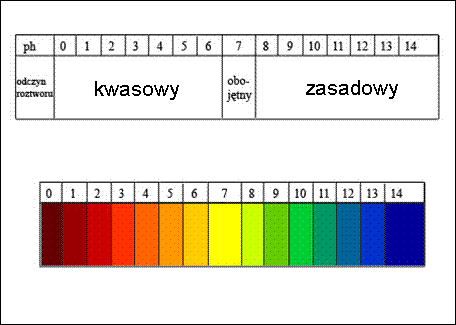
Zależność między skalą a odczynem pH
Aby zrozumieć sens tej skali trzeba się najpierw przyjrzeć temu co dzieje się w czystej (destylowanej) wodzie: cząsteczki wody (H2O) ulegają samorzutnej dysocjacji co prowadzi do powstawania jonów H+ i OH¯:
H-O-H <--> H+ + OH¯
Reakcja ta jest odwracalna i ma równowagę przesuniętą silnie w lewo, czyli w stronę wody niezdysocjowanej.
Reakcja ta powoduje, że stężenie jonów H+ w wodzie destylowanej w temp. 20 0C wynosi dokładnie 10¯7 mol/l.
Zatem łatwo policzyć pH wody destylowanej, która wynosi 7.
pH= 7 stanowi dokładnie środek skali pH.
Dodając do wody silny kwas (np: HCl) zachodzi reakcja dysocjacji tego kwasu:
HCl <--> H+ + Cl¯
Dla tak silnego kwasu jak HCl równowaga tej reakcji jest niemal całkowicie przesunięta w stronę prawą (tzn. w stronę jonów H+ i Cl¯) dlatego dodając do 1 litra wody 1 mol HCl otrzymamy stężenie jonów H+ równe 1 mol/l - teraz łatwo policzyć daje to nam pH=0.
Z drugiej strony dodanie do 1 litra wody 1 mola silnej zasady np. NaOH prowadzi do dodania do układu 1 mola jonów OH¯. Jony OH¯ przesuwają silnie równowagę reakcji dysocjacji wody powodując, że stężenie jonów H+ spada do poziomu 10¯14 mol/l, czyli otrzymujemy pH=14.
W roztworze obojętnym - pH jest identyczne jak w czystej wodzie [“czystej” nie oznacza wziętej z butli z napisem “woda destylowana”. Taka woda zawiera nieznaczne ilości CO2 pochłoniętego z powietrza, który nadaje jej pH ok.5]. Roztwór obojętny (neutralny) należy zdefiniować jako roztwór, w którym stężenia jonów wodorowych i jonów wodorotlenkowych są sobie równe. Dlatego pH takiego obojętnego roztworu może być różne od 7,00.
Odczyn Roztworu
Odczyn roztworu jest cechą roztworu określającą czy w roztworze znajduje się nadmiar jonów wodorowych H+ (odczyn kwasowy), czy nadmiar jonów wodorotlenkowych OH¯ (odczyn zasadowy), czy też są one w równowadze (odczyn obojętny).
Wodne roztwory kwasów wykazują odczyn kwasowy, a wodne roztwory wodorotlenków (zasady)- odczyn zasadowy.
Jeśli zanurzony w wodnym roztworze substancji uniwersalny papierek wskaźnikowy zabarwi się na różowo, można wnioskować, że w tym roztworze jest więcej jonów H+ niż OH-. Jednak niewielka liczba cząsteczek wody ulega dysocjacji. Czyli zawsze w roztworze wodnym występuje pewna liczba (choć bardzo niewielka) jonów wodorowych H+ i wodorotlenkowych OH¯. Np. jeżeli w roztworze pH wynosi 10, oznacza to, że jest więcej jonów wodorotlenkowych OH¯ niż jonów wodorowych H+. Roztwór ten ma więc odczyn zasadowy.
Celem określenia pH roztworu stosuje się tzw. wskaźniki pH (indykatory), czyli substancje, których barwa zmienia się na odpowiedniki kolor w zależności od odczynu roztworu. Wskaźniki uniwersalne, które obejmują szeroki zakres pH (około 10 jednostek pH), pozwalają tylko na oszacowanie wartości pH (z dokładnością do 0,5 ). Jeżeli wymagany jest dokładniejszy pomiar pH roztworu można zmierzyć pH za pomocą urządzenia zwanego pehametrem.
Podsumowanie:
Skala pH to skala kwasowości i zasadowości roztworów wodnych związków chemicznych. Wykładnikiem stężenia jonów wodorowych jest skala pH. Jest ściśle związana z odczynem roztworu.
Odczyn to cecha roztworu zależna od stężenia jonów wodorowych.
• pH 0-7 – odczyn kwasowy
• pH= 7 – odczyn obojętny
• pH 7-14 - odczyn zasadowy
• [H+] > [OH-] odczyn kwasowy
• [H+] = [OH-] odczyn obojętny
• [H+] < [OH-] odczyn zasadowy
Korzystanie ze skali pH
Woda destylowana ma pH = 7.
Jednomolowy roztwór kwasu solnego ma pH = 0,
Jednomolowy roztwór wodorotlenku sodu ma pH = 14.
np.
pH Coca Coli to ok. 2,
pH wody z ogórków to ok 1,
pH suchej skóry to ok. 6.5 - czyli ma odczyn lekko kwasowy.
Do określenia pH służą wskaźniki chemiczne.
Wskaźniki ( indykatory )
substancje zmieniające barwę w zależności od odczynu, takie jak:
• Fenoloftaleina
• Wskaźnik uniwersalny
• Oranż metylowy
• Błękit bromotymolowy
• Lakmus
• Wywar z czerwonej kapusty
• Esencja herbaciana
• Sok z jagód
Znajomość pH wykorzystywana jest w medycynie, rolnictwie, ogrodnictwie i hodowli ryb.
Przykłady skali pH w praktyce:
• w medycynie (pH krwi zdrowego człowieka wynosi 7,4 spadek poniżej 6,8 lub wzrost powyżej 8 powoduje skutki śmiertelne)
• w rolnictwie (pH gleby przy uprawie ziemniaków wynosi 4,5 - 6, ogórków 5,5 - 6,5)
• w ogrodnictwie (pH gleby dla drzew owocowych wynosi 6,5 - 7,7)
• w hodowli ryb(większość gatunków pH 6,4 - 7)





 Słowa kluczowe
Słowa kluczowe






